Mediante el uso de células madre y la edición de genes, los investigadores del Instituto Salk han desenterrado un importante motor de la investigación sobre el envejecimiento, desde el cáncer hasta la diabetes. Ese motor: la pérdida de heterocromatina, que es potencialmente reversible, ya que es un proceso epigenético que no forja inicialmente mutaciones genéticas permanentes.
"Hemos identificado la pérdida de heterocromatina como motor del envejecimiento", declaró a Bioscience Technology el doctor en genética Juan Carlos Izpisua Belmonte. Su equipo está ahora "desarrollando nuevas herramientas de edición epigenética" con las que "podríamos ser capaces de revertir los cambios epigenéticos observados durante el envejecimiento y ralentizar o incluso invertir el proceso de envejecimiento. Ahora trabajamos en el desarrollo de tecnologías de edición epigenética".
"El artículo vincula de forma convincente la deleción del gen WRN (similar a la helicasa RecQ del síndrome de Werner) con la desorganización de la heterocromatina", declaró a Bioscience Technology el biólogo del desarrollo Willis Li, de la Universidad de California en San Diego. "Es otro ejemplo que relaciona la pérdida de heterocromatina con el envejecimiento". El equipo de Li, ajeno al nuevo trabajo, demostró previamente en la mosca de la fruta que el envejecimiento se asocia a una disminución gradual de los niveles globales de heterocromatina. Lo consiguió reduciendo la heterocromatina mediante mutaciones en un gen llamado HP1, lo que aceleró el envejecimiento, mientras que aumentar HP1 potenció los niveles de heterocromatina y prolongó la vida útil. En conjunto, "estos resultados respaldan un modelo de envejecimiento basado en la pérdida de heterocromatina", afirma Li.
El nuevo estudio
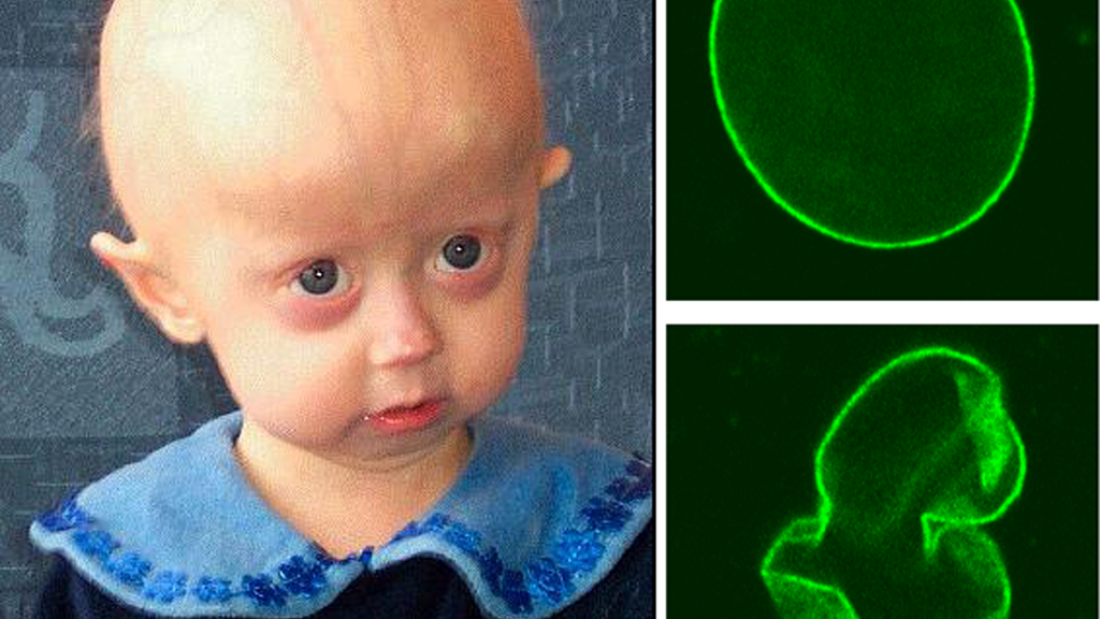
En el número del 30 de abril de Science, el equipo de Belmonte, en asociación con investigadores de la Academia China de Ciencias, descubrió que las mutaciones genéticas del síndrome de Werner provocan alteraciones en la heterocromatina, unos haces de cromatina que desempeñan un papel fundamental en el control de la expresión génica.
El síndrome de Werner es una enfermedad devastadora de investigación del envejecimiento prematuro que conduce a la muerte a los 40 y principios de los 50 años. El síndrome está provocado por una mutación en el gen WRN. El gen sano produce una enzima responsable de mantener la estructura del ADN. Pero cuando muta, en el síndrome de Werner, interfiere en los procesos normales de expansión y reparación del ADN. No se sabe cómo lo hace la proteína WRN anormal.
El equipo de Belmonte creó un modelo celular del síndrome de Werner eliminando el gen WRN de células madre embrionarias (ESC) diferenciadas en células madre mesenquimales adultas (MSC). Este knock-out provocó alteraciones en la heterocromatina, que se encuentra cerca del núcleo celular.
En un trabajo adicional, el equipo reveló que la proteína WRN interrumpe estructuras moleculares bien conocidas por estabilizar la heterocromatina en general. Esto creó, por primera vez, un vínculo entre la desorganización de la heterocromatina y el gen WRN, e implicó también el proceso natural de envejecimiento, no sólo el patológico envejecimiento de Werner.
Lo más sorprendente para Belmonte, según declaró a Bioscience Technology, fue la idea de que el WRN participa en el mantenimiento general de la heterocromatina. "En trabajos anteriores se habían atribuido varias funciones relacionadas con la replicación, reparación y transcripción del ADN a la proteína WRN, la helicasa del ADN mutada en el síndrome de Werner", explicó. "Además, se sabe que WRN desempeña un papel en el mantenimiento de los telómeros. Para nosotros fue sorprendente descubrir que WRN interaccionaba con proteínas implicadas en el mantenimiento de la heterocromatina". Pero lo hace, observaron. Las mutaciones en WRN provocaron alteraciones en la heterocromatina, que impulsan "el proceso de envejecimiento".
Una clave para el equipo pareció ser la elección de las CME para el modelo. Otros grupos han intentado crear células madre a partir de células Werner adultas envejecidas, denominadas células madre pluripotentes inducidas (iPSC). El equipo de Belmonte investigó algunas iPSC de Werner adultas, pero pronto las descartó. Estaban demasiado debilitadas para manejar toda la desdiferenciación y diferenciación. "Nuestro modelo del síndrome de Werner se basa en el uso de ESCs. Para generar este modelo, eliminamos una porción de la proteína WRN, mutada en pacientes con síndrome de Werner. La principal ventaja de este modelo es la posibilidad de generar múltiples tipos celulares en los que podemos estudiar el proceso de envejecimiento."
continuó: "Las IPSC se generan mediante la reprogramación de células somáticas, normalmente células de la piel de un paciente. Descubrimos que la mayoría de las muestras de piel de pacientes con síndrome de Werner disponibles para nuestros estudios presentaban graves anomalías del cariotipo y mutaciones secundarias del ADN. Por estas razones, consideramos que la eliminación de una parte de la proteína WRN en las CME constituirá un mejor modelo para el estudio de la investigación del envejecimiento en el síndrome de Werner."
Fecha: 5 de mayo de 2015
Fuente: http://www.biosciencetechnology.com/articles/2015/05/potentially-reversible-driver-aging-found

Añadir un comentario